4月3日,國際學術期刊PNAS在線發表了中國科學院分子細胞科學卓越創新中心(生物化學與細胞生物學研究所)周斌研究組與香港中文大學呂愛蘭研究組的合作研究成果,題為“Dual genetic tracing demonstrates the heterogeneous differentiation and function of neuromesodermal progenitors in vivo”。該研究構建了雙同源重組酶系統,成功建立了體內神經中胚層祖細胞(Neuromesodermal progenitors,NMPs)的譜系示蹤及功能研究技術,并結合單細胞轉錄組測序技術,深入揭示了NMPs在胚胎發育中的細胞命運和分子特征。這一研究不僅揭示了NMPs在胚胎發育中的分布、分化潛能和功能,更為脊髓損傷的細胞治療提供了新的研究方向。
脊髓作為中樞神經系統的重要組成部分,承擔著神經信號傳導和肌肉運動協調等關鍵功能。然而,目前針對脊索退行性病變及外源性脊髓損傷的治療手段仍存在明顯局限。體外細胞實驗表明,NMPs不僅能夠分化為脊髓中的神經細胞,還可以產生周圍的中胚層組織,在脊髓損傷的細胞治療中具有重要應用前景。盡管既往研究已經證實NMPs具有雙向分化潛能,但缺乏在體內直接示蹤和功能評估的遺傳工具。因此,開發精準靶向體內NMPs的技術對于揭示其細胞命運和功能至關重要。
在該項研究中,研究團隊設計和構建了多種雙同源重組酶系統,成功建立了哺乳動物體內特異性標記NMPs的遺傳譜系示蹤新技術。研究發現,NMPs具有雙向分化潛能,能夠同時生成神經細胞和中胚層細胞。此外,通過特異性清除NMPs的實驗,研究人員發現NMPs減少導致胚胎軀干和尾部發育異常,進一步證實了NMPs在胚胎發育中的關鍵作用。相關研究成果不僅解答了重要的發育生物學問題而且為脊髓損傷的臨床治療提供了重要的理論基礎和研究思路。
研究團隊首先對小鼠胚胎期8.5天的尾端組織進行單細胞測序。通過分析,將細胞主要分為14個不同的簇,包括NMPs、Neural tube、Somite和Presomitic mesoderm等。進一步深入分析,研究人員發現NMPs特異性表達Brachyury(T)和Sox2,同時高表達Nkx1-2、Epha5、Fgf17和Fgf8等分子標志基因。研究還揭示了NMPs的分化受到Wnt、FGF和BMP等信號通路的精密調控:Wnt和FGF信號通路促進NMPs向中胚層分化,而BMP信號通路則通過抑制Sox2的表達推動NMPs向中胚層命運轉變;相反,視黃酸(RA)信號通路通過抑制Wnt信號促進NMPs向神經命運分化。
為精準示蹤NMPs,研究人員利用Dre-rox和Cre-loxP兩套同源重組系統,分別構建了T-DreER和Sox2-CreER基因敲入遺傳工具小鼠,來分別標記T來源和Sox2來源的細胞。研究團隊設計了兩套遺傳策略來特異性標記示蹤體內NMPs。在第一套策略中,研究人員使用Rosa26-traffic light reporter(Rosa26-CAG-rox-Stop-rox-ZsGreen-insulator-CAG-loxP-Stop-loxP-tdTomato,R26-TLR)系統。通過Tamoxifen誘導,可以在T-DreER;Sox2-CreER;R26-TLR小鼠體內同時分別標記T+細胞(ZsG+,綠色熒光)、Sox2+細胞(tdT+,紅色熒光)以及T+Sox2+雙陽性細胞(ZsG+tdT+,呈現黃色熒光)。這一方法成功實現了在單個胚胎中同時追蹤T+、Sox2+和T+Sox2+三群細胞。為了更加清晰直觀的標記NMPs,探究NMPs的細胞定位、細胞運動和分化的細胞類型,研究人員開發設計了第二套策略,R26-RL-GFP(Rosa26 rox-Stop-rox-loxP-Stop-loxP-eGFP)系統。在T-DreER;Sox2-CreER;R26-RL-GFP三基因小鼠中,只有Dre-rox和Cre-loxP雙重重組的情況下才會激活GFP表達,從而特異性地標記T+Sox2+的NMPs。通過這兩套雙重組酶介導的遺傳標記系統,研究人員成功追蹤了NMPs在胚胎發育過程中的時空分布,發現這些細胞主要定位于胚胎的尾部區域,參與神經管、軸旁中胚層以及部分內胚層組織的形成。
為了探究單個NMP是否具有雙向分化潛能,研究團隊利用R26-confetti2報告系統進行單細胞克隆分析。通過低劑量Tamoxifen誘導,研究人員在E8.5成功標記了單個NMP。進一步結果顯示,單個NMP能夠分化為神經細胞克隆、中胚層細胞克隆或同時生成兩種細胞類型的混合克隆。這一發現直接證實了NMPs在體內的雙向分化潛能。此外,研究人員還發現少數NMPs還能夠分化為內胚層細胞。這一發現擴展了NMPs在胚胎發育中的已知貢獻,揭示了其在多胚層組織形成中的潛在作用。
接下來為了進一步闡明NMPs在胚胎發育中的功能,研究團隊開發了T-DreER;Sox2-CreER;R26-LR-DTR小鼠模型,通過雙重組酶介導白喉毒素受體(DTR)的表達,從而特異性清除NMPs。實驗結果顯示,NMPs的清除會導致胚胎軀干和尾部發育嚴重異常,表現為尾部縮短和軀干結構畸形。這一結果直接證明了NMPs在胚胎發育中的關鍵作用。研究還發現,NMPs的清除時間點對其功能影響顯著。E8.5清除NMPs僅導致輕微的尾部發育缺陷,而E10.5清除則會引發嚴重的軀干和尾部發育異常,這一現象可能與胚胎發育過程中其他細胞群體的代償作用有關。
綜上,這項研究通過開發新型遺傳工具,首次在體內實現了對NMPs的特異性遺傳標記、示蹤和功能評估。研究不僅深化了對NMPs在胚胎發育中作用機制的理解,為疾病建模、藥物研發以及細胞治療等領域的發展奠定了重要基礎,更為再生醫學領域提供了新的研究方向,具有重要的科學意義和潛在臨床應用價值。
分子細胞卓越中心周斌研究組副研究員金恒薇和博士生劉子鑫為該論文共同第一作者。分子細胞卓越中心周斌研究員和香港中文大學呂愛蘭教授為該論文共同通訊作者。該研究得到南模生物、國家蛋白質科學中心(上海),以及分子細胞卓越中心動物實驗技術平臺、細胞分析技術平臺和分子生物學技術平臺的大力支持和幫助。該工作得到中國科學院、基金委、科技部、上海市科委、香港研資局、新基石科學基金會等支持。
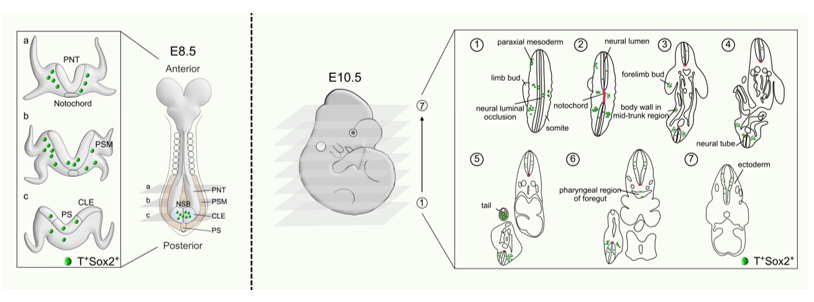
示蹤的NMPs在胚胎E8.5和E10.5的時空分布

 主站蜘蛛池模板:
密云县|
太保市|
辛集市|
安平县|
岑巩县|
平乐县|
吉隆县|
东台市|
烟台市|
呼图壁县|
吐鲁番市|
盐边县|
周口市|
河北区|
久治县|
吴川市|
江山市|
泸水县|
正镶白旗|
扬州市|
秭归县|
贡山|
新绛县|
卫辉市|
抚顺市|
莱州市|
井研县|
赤峰市|
鸡西市|
黎平县|
连江县|
阳朔县|
绥芬河市|
临泉县|
勐海县|
商水县|
阿拉尔市|
若尔盖县|
永胜县|
离岛区|
岱山县|
主站蜘蛛池模板:
密云县|
太保市|
辛集市|
安平县|
岑巩县|
平乐县|
吉隆县|
东台市|
烟台市|
呼图壁县|
吐鲁番市|
盐边县|
周口市|
河北区|
久治县|
吴川市|
江山市|
泸水县|
正镶白旗|
扬州市|
秭归县|
贡山|
新绛县|
卫辉市|
抚顺市|
莱州市|
井研县|
赤峰市|
鸡西市|
黎平县|
连江县|
阳朔县|
绥芬河市|
临泉县|
勐海县|
商水县|
阿拉尔市|
若尔盖县|
永胜县|
离岛区|
岱山县|