賴氨酸作為人體內含量最為豐富的氨基酸之一,在維持蛋白質功能和穩定性中發揮重要的作用,因此實現細胞內賴氨酸的共價修飾能大幅度推動疾病的病理研究以及相關藥物的開發。然而目前已經上市的共價藥物仍以靶向蛋白質的半胱氨酸殘基為主,這是因為在生理條件下,賴氨酸側鏈的氨基處于較低親核活性的質子化狀態而難以實現高效的共價修飾。針對這一難題,中國科學院上海有機化學研究所丁克課題組開發出一種新型的賴氨酸共價修飾結構—鄰氰基苯甲醛(CNBA),CNBA能在活細胞內高效共價修飾蛋白表面和內部的賴氨酸側鏈殘基,為靶向賴氨酸的新型共價抑制劑的開發提供新方法。相關成果以“O?Cyanobenzaldehydes Irreversibly Modify Both Buried andExposed Lysine Residues in Live Cells”為題發表在Journal of the American Chemical Society雜志上(DOI: 10.1021/jacs.4c18006)。
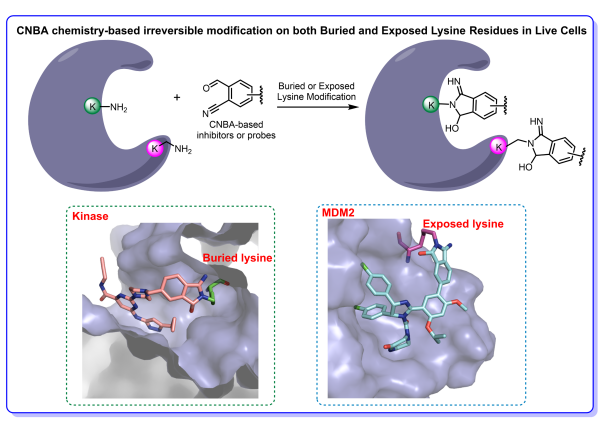
醛基和氰基作為重要的藥物官能團,具有較好的生物相容性,因而被用于多種上市的藥物之中。此外,醛基和氨基即使在較低的pH條件下也能形成可逆的亞胺結構,這使得生理條件下對質子化的低親核性賴氨酸修飾具有一定的可行性。而具有較弱親電活性的氰基能通過鄰基效應捕獲不穩定的亞胺中間體并形成穩定的環合產物,從而實現從可逆共價向不可逆共價的轉變。基于該思路,研究人員對生理條件下CNBA與賴氨酸的反應性和選擇性進行驗證,實驗結果表明CNBA不僅能實現對模型蛋白FKBP12的高效標記,而且具有非常優異的賴氨酸選擇性。此外,CNBA能成功標記Jurkat細胞內3451個的賴氨酸殘基,其中包括多個具有高反應活性的賴氨酸殘基位點。在此基礎上,研究人員將CNBA應用于激酶共價抑制劑、PPI抑制劑和ADC藥物構建。基于CNBA的廣譜激酶抑制劑K-CNBA-1能與Jurkat細胞內85個激酶的保守賴氨酸形成不可逆共價作用,該結果為開發靶向激酶內部賴氨酸的共價抑制劑提供新的方法。而基于CNBA的MDM2-p53抑制劑M-CNBA-1也能與MDM2表面的94位賴氨酸形成共價作用,從而大幅度提高Nutlin類分子的抗腫瘤活性。最后, CNBA也能作為新型的ADC連接子反應基團,在不影響抗體活性的前提下快速構建ADC類藥物分子,為后續ADC的藥物開發提供新的選擇。
綜上,該工作首次報道了一類新型的活細胞內賴氨酸選擇性修飾結構—鄰氰基苯甲醛(CNBA),并在激酶抑制劑、蛋白質—蛋白質相互作用抑制劑和ADC分子構建中實現初步驗證。CNBA結構的高選擇性、高反應性、高穩定性以及高生物相容性將使其有望用于未來的藥物開發之中。
中國科學院上海有機化學研究所丁克研究員和暨南大學張志民研究員為本文的通訊作者,共同第一作者分別為中國科學院上海有機化學研究所博士生凌歡、中國科學院上海有機化學研究所科研助理李林、暨南大學碩士生段莉萍、中國科學院上海有機化學研究所副研究員黃維雪和南方科技大學副研究員鄭江南。
研究工作得到中國科技部重大研發計劃,國家自然科學基金委和中國科學院先導項目等資助。

 主站蜘蛛池模板:
寻乌县|
江北区|
毕节市|
湖北省|
城固县|
吉林省|
越西县|
涟源市|
禄丰县|
湛江市|
荔波县|
高陵县|
高州市|
深州市|
阜南县|
墨脱县|
义马市|
鲜城|
广汉市|
肃北|
老河口市|
桃园市|
百色市|
丹寨县|
丽江市|
涿州市|
炉霍县|
广德县|
桃源县|
无锡市|
清苑县|
岚皋县|
周宁县|
建阳市|
那曲县|
闽清县|
永平县|
大荔县|
江阴市|
元氏县|
辽宁省|
主站蜘蛛池模板:
寻乌县|
江北区|
毕节市|
湖北省|
城固县|
吉林省|
越西县|
涟源市|
禄丰县|
湛江市|
荔波县|
高陵县|
高州市|
深州市|
阜南县|
墨脱县|
义马市|
鲜城|
广汉市|
肃北|
老河口市|
桃园市|
百色市|
丹寨县|
丽江市|
涿州市|
炉霍县|
广德县|
桃源县|
无锡市|
清苑县|
岚皋县|
周宁县|
建阳市|
那曲县|
闽清县|
永平县|
大荔县|
江阴市|
元氏县|
辽宁省|